STANOVENIE ŠPECIFICKÉHO TEPLA TUHÉHO TELA
STANOVENIE ŠPECIFICKÉHO TEPLA TUHÉHO TELA
Princíp: Kalorimetria je časť termodynamiky, ktorá sa zaoberá meraním tepelných veličín. Teplo je forma energie, ktorá je dôsledkom tepelného miešania a meria sa v jouloch (J) alebo kalóriách. Kalória je množstvo tepla, ktoré je potrebné na gram destilovanej vody na zvýšenie jej teploty o jeden stupeň, z 19,5 na 20,5 ° C. Kalória zodpovedá 4,18 joulom v systéme SI. Množstvo tepla prijatého telom závisí od hmotnosti m jeho, o povahe tela, charakterizovanej charakteristickou konštantou, označenou c, a teplotného rozdielu t, ktorý je:
Q = m. c. t
Preto: c =; ak m = 1 a t = 10 dostaneme, c = Q.
Merné teplo je teda množstvo tepla, ktoré potrebuje jednotka hmotnosti v tele na zvýšenie svojej teploty o jeden stupeň. V systéme CGS sa meria v
a v medzinárodnom systéme .
Merné teplo vody je 1 kal/g.grd = 4,18 J/KgK. Je oveľa väčší ako väčšina tiel. Produkt medzi špecifickým teplom a telesnou hmotou sa nazýva kalorická kapacita a označuje sa C = m.c. Produkt medzi špecifickým teplom a molárnou hmotnosťou M sa nazýva špecifické molárne teplo, CM = c.M alebo molárne teplo.
Merné teplo tela sa dá určiť niekoľkými metódami, najjednoduchšie sú založené na metóde zmesí. Je založená na výmene tepla, ktorá sa dosahuje kontaktom dvoch alebo viacerých telies s rôznymi teplotami. Napríklad, ak vložíme do vodného kalorimetra telo, ktorého teplota je vyššia ako teplota vody, bude vydávať určité množstvo tepla. V okamihu tepelnej rovnováhy podľa princípov kalorimetra platí rovnosť:
Q1 = Q2 - Q3, kde Q1 predstavuje množstvo tepla vydaného teplejším telesom, Q2 množstvo tepla absorbovaného vodou v kalorimetri a Q3 množstvo tepla absorbovaného kalorimetrom, miešadlom a teplomerom.
kde: m je hmotnosť tela, ktoré sa má analyzovať, m1 je hmotnosť vody v kalorimetri, m2 je hmotnosť kalorimetra, miešadla a teplomeru, c je merné teplo tela, c1 je merné teplo vody, c2 je merné teplo kalorimetra, teplomeru a miešadla, t2 je konečná teplota zmesi (rovnováha), t je počiatočná teplota tela, t1 je počiatočná teplota vody v kalorimetri, miešadle, teplomeri. Takže t> t2> t1.
Dosadením hodnôt za Q1, Q2 a Q3 získame:
Kalorická kapacita kalorimetra (m2 c2) je stanovená vopred a nazýva sa vodný ekvivalent kalorimetra (označený písmenom A).
Môžeme teda vypočítať merné teplo tela s prihliadnutím na hodnotu vodného ekvivalentu kalorimetra a na skutočnosť, že pre vodu sa merné teplo rovná 1 stupňu cal/g (alebo 4 185 J/kg), máme:
c =
zariadenia: Kalorimetrická nádoba sa skladá z valcovej nádoby B, vloženej do väčšej nádoby C a tepelne izolovanej.
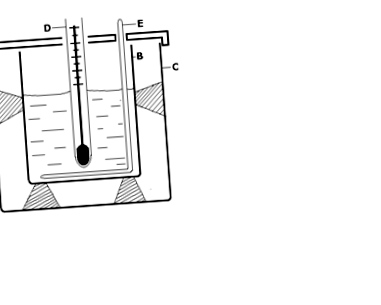
Obr.4.1 Jednotlivé časti kalorimetra.
- Do kalorimetra sa zavedie presne odmerané množstvo vody, m1.
- Zmerajte teplotu vody v kalorimetri t1 (buď ortuťovým teplomerom alebo elektrickým teplomerom)
- Telo sa odváži; potom vložte do hrnca s vriacou vodou, kde ju nechajte niekoľko minút.
- Meria sa teplota vriacej vody, ktorá predstavuje počiatočnú telesnú teplotu t.
- Rýchlo vložte vyhrievané telo do kalorimetra a pomaly pretrepávajte vodu z kalorimetra.
- Postupujte podľa indikácie teplomeru. Keď je stacionárna, hodnota sa načíta. Toto je konečná teplota zmesi t2.
Ak chcete určiť konkrétne telesné teplo, zadajte údaje do vyššie uvedeného vzťahu. Merania a výpočty sa vykonajú pre rôzne materiály: železo, olovo, hliník, zliatiny.
Výsledky sú uvedené v nasledujúcej tabuľke:
(kal/g) g g 0 C 0 C 0 C (kal/g.grad)
Pb
- Telová emulzia Sundari s vyživujúcim a zvlhčujúcim účinkom - Elixirium Farm
- Epidemiológia v roku 2020 Popis práce epidemiológa - MEDIjobs
- Obchod v Novosibirsku predáva zmontované remeslá iPhone 6 pod novým
- Dejiny elektriny ilustrované na stenách rozvodne Enel; Časopis Q
- História elektriny je ilustrovaná na stenách rozvodne Enel