Willebrandova choroba typu 2N-exóny 17, 24-27
Všeobecné informácie a odporúčania
VonWillebrandova choroba (VWD) je spôsobená nedostatkom alebo abnormalitou vonWillebrandovho faktora (FVW) a je najbežnejším dedičným hemoragickým ochorením s prevalenciou 1% v bežnej populácii. Ochorenie prvýkrát charakterizoval Erick von Willebrand v roku 1926 ako autozomálne zdedený patologický stav. VWD je spojená s kvantitatívnymi nedostatkami (typ 1 a typ 3) alebo kvalitatívnymi anomáliami FVW (typ 2, s podtypmi 2A, 2B, 2M a 2N). FVW sa syntetizuje v endotelových bunkách a megakaryocytoch. Jeho gén sa nachádza na krátkom ramene chromozómu 12p13.3, vrátane
178 kilobáz s 52 exónmi, najväčší exón, 28, ktorý má dĺžku 1,4 kb 5 a kóduje proteín usporiadaný do 4 opakujúcich sa domén, vrátane 3 „A“, 3 „B“, 2 „C“ a 4 „D“, ktoré slúžia na rôzne funkcie FVW. Doména A1 obsahuje väzbové miesta pre doštičky GPIb, ristocetín a kolagén typu VI, doména A3 obsahuje väzbové miesto pre kolagén I a III, väzbové miesto FVIII je umiestnené v doménach D 'a D3 a doména C1 obsahuje sekvenciu RGD schopnú interakcia s doštičkami GPIIb/IIIa 1; 2; 4 .
VWD sa môže dediť prostredníctvom viacerých genetických mechanizmov. Väčšina prípadov typov 1 a 2A, ako aj typov 2B a 2M je autozomálne dominantné dedičstvo. Typy 2N a 3, ako aj niektoré typy 1 a 2A sa dedia autozomálne recesívne. Pokiaľ ide o autozomálny dominantný prenos, väčšina postihnutých jedincov má postihnutého rodiča a každé dieťa má 50% šancu na zdedenie mutácie. Pre autozomálny recesívny prenos sú rodičia povinní heterozygoti (kariéry mutovanej alely), zvyčajne asymptomatickí; pri počatí má každý súrodenec postihnutého jedinca 25% pravdepodobnosť postihnutia, 50% pravdepodobnosť, že bude asymptomatickým nosičom a 25% pravdepodobnosť, že nebude postihnutým ani nositeľom, a každé dieťa postihnutého jedinca je povinne heterozygotné .
Mutácie a polymorfizmus génu FvW sú uvedené v medzinárodnej databáze www.shef.ac.uk/vwf/.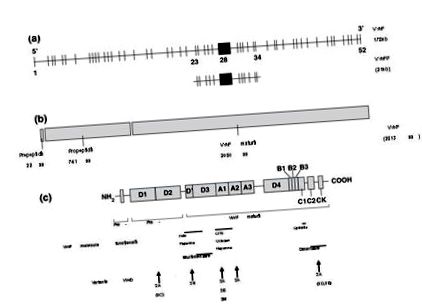
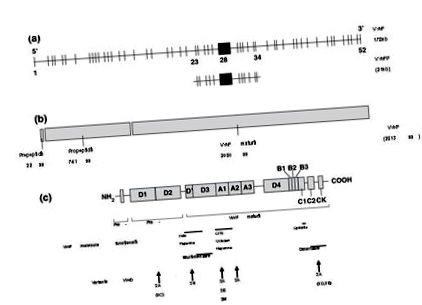
Prevzaté z Keeney et al. 5 .
Funkčné domény génu pre VonWillebrandov faktor (FVW): a) štruktúra génu FVW a pseudogénu; b) pre-, pro-FVW; c) funkčné domény a umiestnenie variantov typu 2.
Boli vykonané štúdie v rodinách s VWD typu 1, ktoré viedli k identifikácii sekvenovaním 112 kandidátskych mutácií, ktoré sú zodpovedné za vznik syndrómu. Okrem toho boli pacienti s VWD typu 1 identifikovaní ako heterozygotní nosiči VWD 9 typu 3. Boli publikované výsledky, podľa ktorých sa bežná mutácia Tyr1584Cys zistila u 14% kanadských pacientov s VWD typu 1 a pravdepodobne podobný podiel u pacientov vo Veľkej Británii 4 .
Mutácie boli detegované u 60-65% pacientov s VWD typu 1, pričom prevažovali mutácie missens; mutácie missens s plne prenikajúcim dominantným prenosom sú často identifikované, keď úrovne FVW: Ag a FVW: RCo sú 3 .
Mutácie spojené s VWD typu 1 ovplyvňujú FVW rôznymi mechanizmami vrátane zníženej sekrécie a intracelulárnej retencie v dôsledku zmeneného intracelulárneho transportu podjednotiek FVW, zvýšeného obehového klírensu alebo v malom počte prípadov zníženej expresie proteínov v dôsledku nulovej alely 2, 3 .
Pretože približne 50% mutácií je lokalizovaných medzi exónmi 18 - 28, sú tieto exóny spočiatku analyzované, ale kompletné informácie poskytuje sekvenovanie celého génu.
Typ 3, zodpovedný za 1-5% prípadov VWD, je najťažšou formou, ktorá je výsledkom úplného nedostatku syntézy FVW. Hemoragické ochorenie je všeobecne diagnostikované v detstve, tvorba hematómov je bežná a môže sa vyskytnúť hemartróza v dôsledku nízkych hladín FVIII zistených v tejto forme ochorenia. U týchto pacientov je hladina FVW prakticky nedetegovateľná a hladina FVIII je zvyčajne 1 - 10 IU/dl, podobne ako pri ľahkej až stredne ťažkej hemofílii A. Genetická analýza odhalila homozygotné alebo dvojité heterozygotné defekty génu FVW, pričom mutácie sa zaznamenali v celej kódujúcej oblasti génu (exóny 2 - 52), vrátane veľkých alebo malých delécií génu, mutácií čítacieho rámca, mutácií zostrihu. „innadire“), mutácie miss alebo nonsens 2; 4. Kompletné sekvenovanie identifikovaných mutácií v 80-90% prípadov VWD typu 3:
-20% sú miss mutácie lokalizované v doménach D1-D2 (exóny 3-11) a D4-CK (exóny 37-52);
-80% sú nulové alely umiestnené na úrovni celého génu, ktoré môžu byť výsledkom rôznych typov mutácií a ktoré neprodukujú funkčný proteínový produkt 3 .
Mutácie v čítacom a nezmyselnom rámci, vedúce k strate expresie FVW proteínu alebo syntéze skráteného značeného FVW proteínu, boli identifikované v rodinách s VWD typu 3, pričom za väčšinu zodpovedá mutácia v čítacom rámci na exóne 18. prípadov VWD typu 3 vo švédskej populácii a je bežný v Nemecku. Táto mutácia pozostáva zo stabilnej mRNA kódujúcej skrátený proteín, rýchlo degradovanej na bunkovej úrovni 4 .
V malom počte rodín boli identifikované rozsiahle delécie génu, ktoré však predstavujú zvýšené riziko pre vývoj aloprotilátok proti FVW po liečbe koncentrátmi FVW.
Laboratórne hodnotenie rodičov pacientov s VWD typu 3 môže preukázať mierny kvantitatívny nedostatok VWD, ale častejšie sú asymptomatické v súlade s autozomálne recesívnym spôsobom prenosu VWD typu 3. Príbuzenstvo je v rodinách s týmto variantom 2; 4 bežné. Avšak v niektorých rodinách s nezmyslami a mutáciami čítacieho rámca boli identifikovaní heterozygoti so zjavným VWD typu 1. Mutácie, ktoré vedú k abnormálnym podjednotkám FVW, ktoré interferujú dominantne negatívnym spôsobom s normálnou alelou, môžu obzvlášť spôsobiť symptomatickú VWD u heterozygotov 4 .
Typ 2 zahŕňa kvalitatívne typy VWD a môže predstavovať až 20 - 25% prípadov VWD. Podozrenie na typ 2 je podozrenie, ak je závažnosť pacientových príznakov nadmerná v porovnaní s hladinami FVW a FVIII, keď dôjde k nesúladnému zníženiu medzi FVW: Ag a FVW: RCo alebo FVIII alebo ak dôjde k súčasnému nedostatku FVW a trombocytopénie. Podľa povahy funkčnej chyby sa typ 2 klasifikuje na typy 2A, 2B, 2M a 2N 2 .
-Typ 2B je paradoxné hemoragické ochorenie charakterizované zvýšenou interakciou FVW s krvnými doštičkami, po ktorom nasleduje zvýšená tvorba komplexov FVW-doštičky a ich vylučovanie z obehu. Mnoho z týchto pacientov má miernu pretrvávajúcu trombocytopéniu, ktorá sa môže zhoršiť počas stresu, tehotenstva, chirurgického zákroku alebo desmopresínu. Multimérová analýza odhaľuje, rovnako ako u typu 2A, absenciu foriem s vysokou molekulovou hmotnosťou a štúdie agregácie krvných doštičiek indukované nízkymi dávkami ristocetínu zdôrazňujú zvýšenú interakciu FVW s krvnými doštičkami. Typ 2B sa dedí ako autozomálne dominantná krajina, malá skupina mutácií missens v časti exónu 28 kódujúca doménu Al, ktorá interaguje s doštičkovým GPIb, je zodpovedná za všetky hlásené prípady 2. 4 mutácie zoskupené medzi Arg543 a Arg578 sú zaznamenané u viac ako 80% pacientov 4. Mutácie ovplyvňujúce p.P1266L môžu demonštrovať iba zvýšenú väzbu GP1b, ale žiadnu trombocytopéniu a stratu multimérov s vysokou molekulovou hmotnosťou 3 .
-Typ 2M vyznačuje sa nedostatkom funkcie FVW závislou od krvných doštičiek, ktorý sa nedá pripísať nedostatku multimérov. To, čo odlišuje typ 2M od typu 2A, je to, že multimérová analýza je normálna. Typ 2M sa dedí ako autozomálne dominantná krajina s mutáciami v oblasti exónu 28 kódujúcimi doménu Al FVW, ktorá mení konformáciu proteínu v alternatívnej oblasti k typu 2B2. Nedávno bola v európskych rodinách zaznamenaná rekurentná mutácia Arg1205His - VWD 2M Vicenza, ktorá sa vyznačuje nízkou hladinou FVW: Ag a prítomnosťou multimérov s vyššou ako normálnou molekulovou hmotnosťou („nadprirodzená“). Ochorenie bolo pôvodne diagnostikované ako VWD typu 1 u pacientov v regióne Vicenza Italy 1; 4; 8 .
-Typ 2N (predtým nazývaný Normandský typ) zahŕňa mutácie, ktoré ovplyvňujú interakciu FVW s FVIII, ktorá vedie k „autozomálnej hemofílii“, s hladinami FVIII medzi 5 a 30 IU/dl, zvyšok laboratórnych parametrov, FVW: Ag a FVW: RCo, je v normálny limit. Bolo identifikovaných 37 mutácií 4, z ktorých väčšina zahŕňala exóny 18, 19 a 20, ktoré kódujú veľkú časť väzbovej domény FVIII a oveľa menší podiel v exónoch 17 a 24-27 3. Tento typ sa dedí autozomálne recesívne, takže postihnutí pacienti musia zdediť od svojich rodičov dve 2N alely alebo 2N alelu od jedného rodiča a VWD typu 1 od druhého rodiča 2. Väčšina jedincov sú zložené heterozygoti pre Missenovu mutáciu a mutáciu, ktorá vedie k nulovej alele, menej často sú zložení heterozygoti pre 2 Missenove mutácie a časť je homozygotná pre missenskú mutáciu, najmä p.Arg854Gln, ktorá sa vyskytuje v 1% kaukazskej populácie 3 .
Genetické testovanie nie je všeobecne potrebné na stanovenie diagnózy vWD, ale môže poskytnúť ďalšie informácie týkajúce sa patogenézy, odpovede na liečbu desmopresínom, genetického poradenstva alebo rizika tvorby aloprotilátok. .
Genetické testovanie je zvlášť užitočné na diferenciáciu typov 2B typu 2B, ako aj na diagnostiku VWD typu 2N, respektíve u pacientov s miernou až stredne ťažkou hemofíliou A s atypickou dedičnosťou alebo s krátkodobým prežitím infúzneho FVIII, ktoré nie je spôsobené špecifickými inhibítormi. alebo znížená aktivita FVIII u žien bez rodinnej anamnézy hemofílie A. Pacienti by mali byť spočiatku testovaní na mutácie v géne FVIII, a pokiaľ chýbajú, mali by sa vyšetriť exóny FVW 3; .
Testovanie nosičov členov rodiny s rizikom autozomálne recesívneho VWD je možné, akonáhle sú v rodine identifikované pôvodcovia mutácií 3 .
Prenatálna diagnostika u vysokorizikových tehotenstiev (zvyčajne u typu 3) je možná analýzou DNA extrahovanej z plodových buniek získaných amniocentézou v 15. - 18. týždni tehotenstva alebo z choriových klkov v 10. - 12. týždni tehotenstva, ak mutácia/príčinné mutácie v rodine sú/sú známe, alebo ak mutácie nie sú známe, je možné diagnostikovať diagnózu analýzou genetických väzieb pomocou širokého panelu známych polymorfizmov v géne FVW, ak je štruktúra rodiny dostatočná, výsledky je možné získať rýchlejšie než identifikácia mutácií v oboch alelách 3; 4 .
Odobratý exemplár - krv príde 6 .
Zberová nádoba - vacutainer obsahujúci EDTA ako antikoagulant 6 .
Zozbierané množstvo - koľko umožňuje vákuum 6 .
Dôvody zamietnutia skúsiť - použitie heparínu ako antikoagulancia 6 .
Vyskúšajte stabilitu - 7 dní pri 2 - 8 ° C 6 .
K dispozícii sú nasledujúce varianty testu:
-VWD typu 2N - sekvenovanie exónov 17, 24-27 (zvyšok mutácií je možné identifikovať) 6 .
Limity a interferencie
Súčasná klasifikácia neobmedzuje VWD na mutácie lokalizované v géne FVW. Vyhodnotenie celého génu nemôže identifikovať existenciu mutácie v prípadoch zjavnej VWD. Nemožnosť identifikácie príčinnej mutácie teda nevylučuje diagnózu VWD.
Normálne varianty génu FVW sú veľmi bežné, v súčasnosti je známych asi 150 normálnych variantov. Tento zvýšený stupeň polymorfizmu spolu s veľkou veľkosťou génu a prítomnosťou parciálneho pseudogénu (lokalizovaného na chromozóme 22q a zodpovedajúceho exónom 23-34) môže sťažiť úplnú sekvenciu génu a interpretáciu údajov 3; 8. Okrem toho sú genetické chyby z kvantitatívnych nedostatkov FVW distribuované po celom géne, čo komplikuje hodnotenie.
Doštičkový typ VWD je výsledkom mutácií v GP1BA, ale prejavuje sa fenotypicky ako VWD typu 2B.
Získaný vonWillebrandov syndróm je mierne až stredne závažné hemoragické ochorenie, ktoré nie je spôsobené mutáciou génu FVW, ktoré sa najčastejšie vyskytuje u ľudí nad 40 rokov bez predchádzajúceho krvácania a je spojené s rôznymi stavmi: lymfoproliferatívne syndrómy, paraproteinémie, choroby. autoimunitný, antifosfolipidový syndróm, zvýšená proteolýza FVW v dôsledku konformačných zmien vyvolaných zvýšenými trecími silami (aortálna stenóza, defekt komorového septa), výrazná trombocytóza, odstránenie FVW z obehu v dôsledku väzby nádorových buniek (Wilmov nádor alebo niektoré lymfoprolické ochorenia), znížená syntéza FVW (hypotyreóza), lieky (kyselina valproová, ciprofloxacín, griseofulvín) 3 .
1. Castaman G, Tosseto A, Rodeghiero F. „von Willebrandova choroba“. In Practical Hemostasis and Trombosis, O’Shaughnessy D, Makris M, Lillicrap D eds, Blackwell Publishing, 2008, 53-54.
2. Friedman K, Rodgers G. „Dedičné poruchy zrážania“. In Wintrobe`s Clinical Hematology, Greer J, Foerster J, Lukens J, Rodgers G, Pareskevas F, Glader B, 11. vydanie, Lippincott Williams & Wilkins, 2004, 1392-94.
3. Goodeve A, James P. „von Willebrandova choroba“. GeneReviews, NCBI Bookshelf.
4. Johnsen J, Ginsburg D. „von Willebrandova choroba“. In Williams Hematology, Lichtman M, Beutler E, Kipps T, Seligsohn U, Kaushansky K, Prchal J., 7. vydanie, McGraw-Hill Medical, 2006, 1929-37.
5. Keeney S, Bowen D, Cumming A, Enayat S, Goodeve A, Hill M. „Molekulárna analýza von Willebrandovej choroby: usmernenie od organizácie Haemophilia Genetics Laboratory Network britskej asociácie lekárov pre hemofilické centrum. Hemofília, (2008); 14: 1099–111.
6. Laboratórium Synevo. Konkrétne odkazy na použitú technológiu práce, 2010. Typ referencie: katalóg.
7. Klinika Mayo, Mayo Medical Laboratories. Referenčné laboratórne služby pre organizácie zdravotnej starostlivosti. von Willebrandova choroba 2N (podtyp Normandia), krv. www.mayomedicallaboratories.com. 2010. Typ odkazu: Internetová komunikácia.
8. Online Mendelian Inheritance in Man, McKusick-Nathans Institute of Genetic Medicine, Johns Hopkins University School of Medicine. „Von Willebrandova choroba“.
9. Rajiv K. Pruthi, MBBS, „Praktický prístup k genetickému testovaniu na von Willebrandovu chorobu“, Mayo Clinic Proceedings (máj 2006) 81; 5: 679-691.
- Nealkoholické tukové ochorenie pečene postihuje 20 - 30% aktívnej populácie
- Refluxná choroba
- Nealkoholické tukové ochorenie pečene
- Nealkoholické tukové ochorenie pečene
- Zápalové ochorenie čriev Nestlé Health Science